Informasjon om biokjemiske forhold ved porfyrisykdommer
Generelt om porfyriner
Det finnes nesten ikke noen sykdom hvor de biokjemiske reaksjonene er så godt kartlagt som for porfyrisykdommene. Dette ble i stor grad gjort allerede på 1920-tallet da man kjemisk beskrev porfyrinmolekylet. Videre forskning viste at porfyrin var en del av hemoglobinet. Faktisk er det dette molekylet som gjør at blodet er rødt. Går en til planteriket finner en samme molekyl igjen i klorofyllet. Porfyrinmolekylet har en nøkkelrolle både i plante- og dyreriket. Ved hjelp av lys og denne kjemiske strukturen danner plantene sukker med karbondioksyd og vann som råstoff, mens oksygenet blir fraktet rundt i kroppen takket være hemoglobin som inneholder et porfyrinmolekyl og jern. Porfyrinmolekylet kombinert med jern kalles heme.
Porfyriner er forstadier til heme
Det var studier av porfyrisykdommer som i sin tid førte til en forståelse av hvordan hemoglobinmolekylet er bygget opp. Dannelsen av et molekyl heme skjer trinnvis i en lengre produksjonskjede ved hjelp av åtte forskjellige enzymer (enzymene fungerer som en katalysator). De uferdige forstadiene i denne produksjonsrekken kalles porfyriner og sluttproduktet som inneholder jern er heme. Produksjonen av heme styres av det første enzymet i produksjonskjeden (ALA-syntetase) ved at overskudd av sluttproduktet heme bremser starten av denne produksjonskjeden (negativ feedback). På denne måten blir det en balanse mellom produksjon og behov. Heme sammenkobles med protein og danner det ferdige hemoglobinet. I leveren brukes heme til mange viktige enzymer som blant annet har å gjøre med nedbrytningen av legemidler.
Hva galt skjer i produksjonen av heme?
Det er åtte ulike enzymer som gjør at trinnene i dannelsen av heme skjer på en korrekt måte. Hvis ett av enzymene i heme-produksjonen fungerer dårlig, resulterer dette i en porfyrisykdom. Årsaken til den dårlige funksjonen i enzymet er vanligvis en feilkoding (genmutasjon) i arveanlegget for enzymet. Når ett enzym i produksjonskjeden av heme fungerer dårlig, vil dette føre til en opphopning av de porfyrinene som er dannet i forkant av det aktuelle enzymet. Denne opphopningen vil skje på samme måten som det som kan oppstå i samlebåndsproduksjon i en bedrift. Dersom en av arbeidsoperasjonene i en produksjonskjede utføres mye langsommere enn normalt, vil det hope seg opp med de mellomproduktene som produseres før den aktuelle arbeidsoperasjonen.
Overproduksjon av visse varianter av porfyriner
Porfyrisykdom skyldes nedsatt funksjon i ett av de åtte enzymene som inngår i heme-produksjonen. Hvilket av de forskjellige enzymene som er rammet, bestemmer hvilken type porfyrisykdom som utvikles. Forskjellige varianter av porfyriner (uroporfyrin, coproporfyrin, protoporfyrin) og forstadier til porfyriner (ALA og PBG) kan derfor hope seg opp i kroppen ved de ulike formene for porfyrisykdom avhengig av hvilket enzym som har utilstrekkelig funksjon (Se figur 1). At ulike typer porfyrisykdom kan ha vidt forskjellige symptomer, skyldes kjemiske forskjeller ved de ulike kjemiske variantene av porfyrinene.
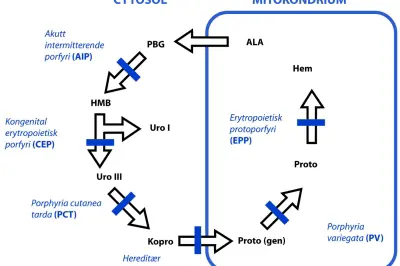
Figur 1. Heme blir dannet i en nøye kontrollert prosess ved hjelp av enzymer lokalisert i cellenes mitokondriene og i cytosol. Ved de forskjellige porfyrityper er det defekter i ulike enzymer. Hemesyntesen starter ved at succinyl-CoA og glycin danner ∂--aminolevulinsyre (ALA) i mitokondriene. Fire molekyler ALA kondenseres til porfobilinogen (PBG) utenfor mitokondriene. Hydroksymetylbilan (HMB) dannes fra PBG. Videre vil HMB omdannes til uroporfyrinogen III (Uro III) som igjen via flere steg omdannes til koproporfyrinogen (Kopro). Koproporfyrinogen transporteres inn i mitokondriene og omdannes til protoporfyrinogen (Proto(gen)) som igjen oksideres til protoporfyrin (proto). Heme dannes ved at jern inkorporeres i protoporfyrin. Pilene representerer overganger som skjer ved hjelp av et enzym. De ulike porfyrier skyldes enzymatiske defekter, markert med tykk strek.